Abbastanza divertente da risolvere. La prima cosa da sapere è che esiste un requisito stereoelettronico per il gruppo migrante di essere anti al gruppo uscente ( $ \ ce {N2 +} $ span>), per motivi di sovrapposizione orbitale.
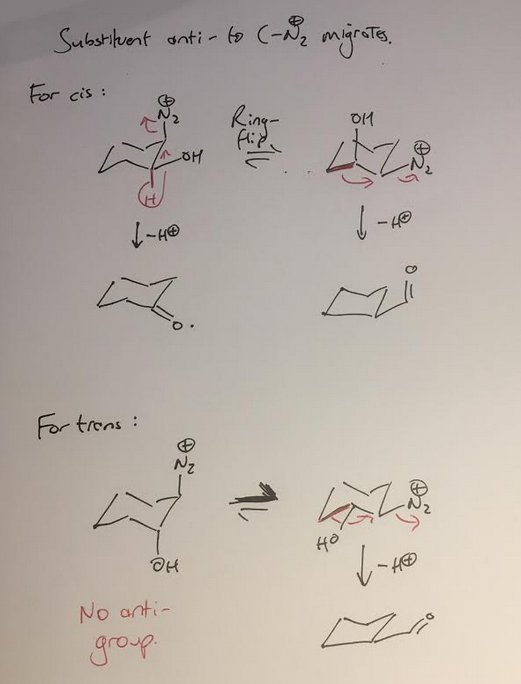
(scusa per il disegno a mano, lo faccio sul mio telefono)
È necessario considerare le conformazioni a poltrona di entrambi gli stereoisomeri, in entrambe le possibili forme di ring-flip. Per lo stereoisomero cis , ti aspetteresti approssimativamente una miscela 1: 1 di forme ad anello. Quando il $ \ ce {OH} $ è assiale, il gruppo anti a LG è H, e si forma il cicloesanone. Allo stesso modo, quando $ \ ce {OH} $ è equatoriale, il legame $ \ ce {CC} $ è anti e si forma il prodotto ciclopentano.
Ora, per l'isomero trans ci sono due fattori che favoriscono il ciclopentano. In primo luogo, predominerà la forma della sedia in cui entrambi i gruppi sono equatoriali, e questo è lo stereoisomero che porta al ciclopentano. In secondo luogo, nel conformer (minore) dove $ \ ce {OH} $ e $ \ ce {N2} $ sono assiali, non esiste un gruppo anti da migrare secondo il normale meccanismo. L'OH stesso è anti a $ \ ce {N2} $ , e non ne sono a conoscenza (a dir poco) di qualsiasi esempio di spostamenti 1,2-idrossi. Tuttavia, prevedo che un po 'di epossido potrebbe formarsi tramite un percorso S N 2.