Nelle industrie farmaceutiche, $ 56 \% $ dei farmaci attualmente in uso sono molecole chirali e $ 88 \ % $ di questi ultimi sono commercializzati come racemati (o miscele racemiche), costituiti da una miscela equimolare di due enantiomeri.
Più recentemente, i farmaci originariamente commercializzati come miscele racemiche sono reintrodotto utilizzando l'isomero attivo. Gli esempi includono citalopram racemico (nome del marchio: Celexa tra gli altri) e il suo enantiomero S , escitalopram (nome del marchio : Cipralex e Lexapro tra gli altri); omeprazolo racemico e il suo enantiomero S esomeprazolo ; e racemico modafinil e il suo R -enantiomero armodafinil.
A volte, la differenza nell'attività farmacologica tra stereoisomeri è drammatica. Gli isomeri destrogiro della serie morfina sono sedativi della tosse con un minor rischio di abuso di sostanze, mentre gli isomeri levogiri contengono l'attività analgesica e un rischio significativo di abuso di sostanze. Sebbene la direzione della rotazione ottica sia opposta a quella della serie di morfine, destropropossifene contiene l'attività analgesica e l'isomero levo contiene attività antitosse.
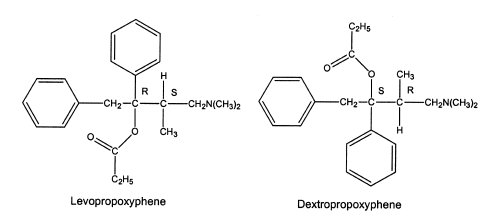
Alcuni sono stati originariamente approvati come miscele racemiche e in seguito è stato commercializzato un isomero specifico con la pretesa di avere meno reazioni avverse nei pazienti.
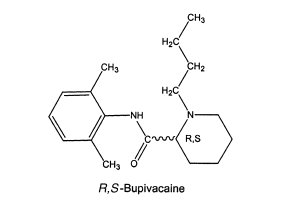
Un esempio di quest'ultimo è l'anestetico locale levobupivacaina, che è l'isomero S della bupivacaina. Entrambi gli isomeri R e S hanno una buona attività anestetica locale, ma l'isomero R può causare depressione del miocardio con conseguente diminuzione del uscita, ipotensione da blocco cardiaco, bradicardia e aritmie ventricolari. Al contrario, l'isomero S mostra meno risposte cardiotossiche ma ancora una buona attività anestetica locale. Escitalopram è l'isomero S dell'antidepressivo citalopram. Ci sono alcune prove che l'isomero R , che contiene poca inibizione selettiva della ricaptazione della serotonina, contribuisce maggiormente alle reazioni avverse rispetto all'isomero S .
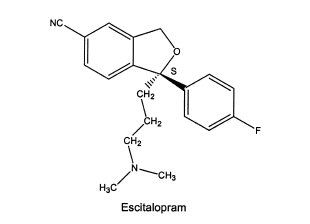 Il reintrodotto S-enantionmer di citalopram con effetti collaterali meno pronunciati
Il reintrodotto S-enantionmer di citalopram con effetti collaterali meno pronunciati
La seconda parte è un po 'complicata, ma ci sono diverse possibilità.
i. Configurazione assoluta
I due enantiomeri di un farmaco chirale vengono meglio identificati sulla base della loro configurazione assoluta o della loro rotazione ottica. La configurazione assoluta in un centro chirale è designata come R - o S - per descrivere in modo univoco la struttura tridimensionale della molecola. Un farmaco chirale può avere più di un centro chirale e in questi casi è necessario assegnare una configurazione assoluta a ciascun centro chirale all'interno della molecola.
Sebbene gli enantiomeri dei farmaci chirali abbiano la stessa connettività chimica di atomi, mostrano marcate differenze nella loro farmacologia, tossicologia, farmacocinetica, metabolismo ecc. Pertanto, quando i farmaci chirali vengono sintetizzati, tanto sforzo va verso la rigorosa separazione dei due enantiomeri. Ciò garantisce che solo l'enantiomero biologicamente attivo sia presente nella preparazione finale del farmaco.
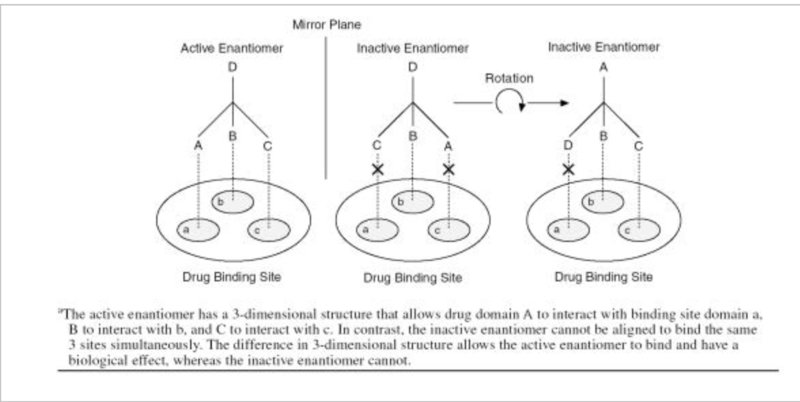
La differenza tra due enantiomeri di un farmaco è illustrata di seguito utilizzando un'ipotetica interazione tra un farmaco chirale e il suo sito di legame chirale. In questo caso, un enantiomero è biologicamente attivo mentre l'altro enantiomero non lo è. Le porzioni del farmaco etichettate A, B e C devono interagire con le regioni corrispondenti del sito di legame etichettate a, b e c affinché il farmaco abbia il suo effetto farmacologico. L'enantiomero attivo del farmaco ha una struttura tridimensionale che può essere allineata con il sito di legame per consentire ad A di interagire con a, B di interagire con be C di interagire con c. Al contrario, l'enantiomero inattivo non può legarsi allo stesso modo, indipendentemente da come viene ruotato nello spazio. Sebbene l'enantiomero inattivo possieda tutti gli stessi gruppi A, B, C e D dell'enantiomero attivo, non possono essere tutti allineati simultaneamente con le regioni corrispondenti del sito di legame:
Ecco un altro esempio di epinefrina:
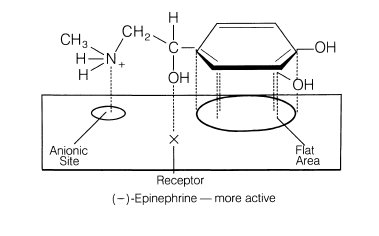
Un adattamento postulato al recettore dell'adrenalina può spiegare perché (-) - l'adrenalina mostra un'attività vasocostrittrice da 12 a 15 volte superiore rispetto alla (+) - epinefrina.
Questo è il classico tre punti modello di attacco. Per l'adrenalina, l'anello benzenico, l'idrossile benzilico e l'ammina protonata devono avere la stereochimica vista con l'isomero (-) per combaciare con la regione idrofoba o aromatica, il sito anionico e un centro di legame idrogeno sul recettore. L'isomero (+) (l'immagine speculare) non si allinea correttamente sul recettore.
ii. Un'altra possibilità
È difficile concludere che un isomero sia superiore all'altro. Ad esempio, S -verapamil è uno stereoisomero farmacologico più attivo di R -verapamil, ma il primo viene metabolizzato più rapidamente dall'effetto di primo passaggio. Il primo passaggio si riferisce ai farmaci somministrati per via orale che vengono ampiamente metabolizzati durante il passaggio attraverso il fegato.
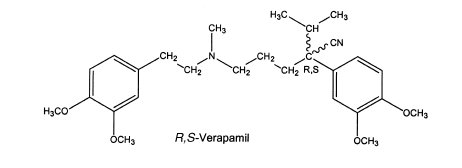
Ciò dimostra che a volte la configurazione assoluta ha scarso impatto sull'attività farmacologica e talvolta fa poca differenza se viene somministrata una miscela racemica o un isomero.
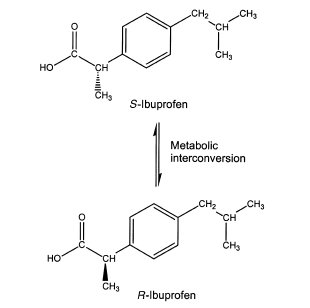
Il popolare farmaco antinfiammatorio non steroideo (FANS) l'ibuprofene viene venduto come miscela racemica. L'enantiomero S contiene l'attività antinfiammatoria inibendo la cicloossigenasi. L'isomero R ha un'attività analgesica ad azione centrale, ma viene convertito nella forma S in vivo .
In alcuni casi, la porzione di una molecola contenente i centri chirali può trovarsi in una regione che non ha un ruolo nel la capacità della molecola di interagire con il suo bersaglio . In questi casi, i singoli enantiomeri possono mostrare una farmacologia molto simile o addirittura equivalente nel loro sito target. Anche in questi casi, gli enantiomeri possono differire nei loro profili metabolici e nelle loro affinità per altri recettori, trasportatori o enzimi.
Il corpo con i suoi numerosi composti omochirali essendo chirale selettivo, interagirà con ciascun farmaco racemico in modo diverso e metabolizzerà ciascun enantiomero attraverso un percorso separato per generare attività farmacologiche diverse. Pertanto, un isomero può produrre le attività terapeutiche desiderate, mentre l'altro può essere inattivo o, nel peggiore dei casi, produrre effetti indesiderati o tossici.
Anche se leggermente fuori tema, è importante notare che in ambito farmacologico , l'attività dei farmaci racemici può essere suddivisa in tre gruppi principali:
-
Gruppo 1. Farmaci racemici con uno dei principali enantiomeri bioattivi
-
Gruppo 2. Farmaci racemici con enantiomeri altrettanto bioattivi
-
Gruppo 3. Farmaci racemici con inversione chirale
Nel complesso, è fondamentale distinguere il singolo enantiomero dalla forma racemica perché possono differire per dosaggi, efficacia, profili di effetti collaterali o persino uso indicato.
La decisione di utilizzare un singolo enantiomero rispetto a una miscela di enantiomeri di un particolare farmaco deve essere effettuata sulla base dei dati provenienti da studi clinici e dall'esperienza clinica.
I due enantiomeri di un farmaco chirale possono differire in modo significativo nella loro biodisponibilità, velocità di metabolismo, metaboliti, escrezione, potenza e selettività per recettori, trasportatori e / o enzimi e tossicità. L'uso di farmaci a singolo enantiomero può potenzialmente portare a profili farmacologici più semplici e selettivi, indici terapeutici migliori, farmacocinetica più semplice a causa dei diversi tassi di metabolismo dei diversi enantiomeri e ridotte interazioni farmacologiche.
Riferimenti
-
Farmaci chirali
-
Analisi farmaceutica: David C . Lee, Michael L. Webb, Eds ,, Analisi farmaceutica ; 1st Edn., CRC Press LLC (per conto di Blackwell Publishing Ltd.): Boca Raton, FL, 2003.
-
Chimica per le bioscienze: Jonathan Crowe e Tony Bradshaw, In Chimica per le scienze biologiche: concetti essenziali ; 3rd Edn., Oxford University Press: Oxford, Regno Unito, 2014.
-
Chiral Drugs: Lien Ai Nguyen1, Hua He, Chuong Pham-Huy, "Chiral Drugs: An Overview , " International Journal of Biomedical Science 2006 , 2 (2) , 85-100 ( https: //www.ncbi. nlm.nih.gov/pmc/articles/PMC3614593/); Disponibile anche su: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3614593/).
-
Stereochemistry in Drug Action: Jonathan McConathy, Michael J. Owens, "Stereochemistry in Drug Action", Primary Care Companion to The Journal of Clinical Psychiatry 2003 , 5 (2) , 70-73 (doi: 10.4088 / pcc.v05n0202); Disponibile anche su: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC353039/.
-
Chimica medicinale organica e Chimica farmaceutica: John M. Beale, Jr., John H. Block (a cura di), il libro di testo di Wilson e Gisvold di chimica organica medicinale e chimica farmaceutica ; 12th Edn., Lippincott Williams & Wilkins (un'azienda Wolters Kluwer): Baltimore, MD, 2011.