Come forse saprai dalle reazioni di diazotizzazione, $ \ ce {HNO2} $ è un generatore del catione di nitrosonio, $ \ ce {NO +} $. Elettrofili come questi possono reagire con l'enol tautomero dell'esanedione:
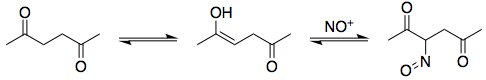
Successivamente, si tautomerizza il composto nitroso all'ossima. Il meccanismo è esattamente analogo alla tautomeria cheto-enolica:
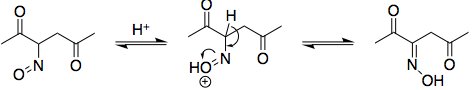
Nota che ho scelto di disegnare l'ossima con un ( E ) -configurazione. Possono formarsi ossime ( E ) e ( Z ), ma l'ossima configurata con ( Z ) non può ciclizzare nel passaggio successivo per formare un isossazolo:
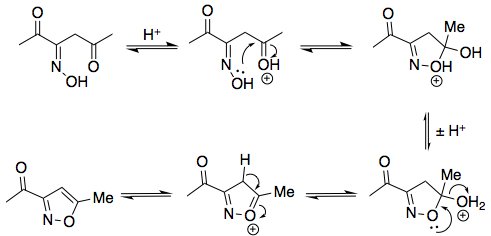
In seguito, per arrivare al composto nella tua domanda, dovresti presumibilmente ossidare il sostituente acetile ($ \ ce {COCH3} $) a un sostituente carbossilico ($ \ ce {COOH} $). L'acido nitroso non è un ossidante, il che solleva dubbi sul fatto che la tua fonte sia autentica (forse è solo un errore di battitura).
In letteratura, trovo che questa ossidazione sia ottenuta utilizzando acido nitrico, $ \ ce {HNO3} $, che è un ossidante perfettamente fine. In un caso ( J. Heterocycl. Chem. 2009, 46, 909), il dichetone viene prima trattato con acido nitroso per ottenere il 3-acetilisossazolo, e viene poi trattato con acido nitrico per formare il 3-carbossilisossazolo. In un caso separato ( J. Med. Chem. 2004, 47, 3642), il dichetone è semplicemente riflusso con acido nitrico per formare il 3-carbossilisossazolo. Ho il sospetto che questo funzioni perché l'acido nitroso è presente nell'acido nitrico, quindi il percorso meccanicistico è esattamente lo stesso (un effetto simile è stato osservato con la nitrazione dei fenoli utilizzando acido nitrico diluito).
Esattamente come L'acido nitrico ossida un gruppo acetile in un gruppo carbossilico, tuttavia, non lo so (e non sono sicuro che sia noto).
Modifica: Esiste, infatti, un meccanismo mediante il quale l'acido nitroso può ossidare il gruppo acetile in un carbossile; vedi la risposta di user55119.