2017-10-27 Update
[NOTA: la mia precedente risposta incentrata sulla notazione, invariata, è sotto questo aggiornamento.]
Sì. Sebbene avere un ottetto di elettroni di valenza crea un minimo di energia eccezionalmente profondo per la maggior parte degli atomi, è solo un requisito minimo, non fondamentale. Se ci sono fattori di energia di compensazione sufficientemente forti, anche gli atomi che preferiscono fortemente gli ottetti possono formare composti stabili con più (o meno) degli 8 elettroni del guscio di valenza.
Tuttavia, gli stessi meccanismi di legame che consentono la formazione di maggiori I gusci di valenza -than-8 consentono anche interpretazioni strutturali alternative di tali gusci, a seconda principalmente se tali legami sono interpretati come ionici o covalenti. L'eccellente risposta di Manishearth esplora questo problema in modo molto più dettagliato di me qui.
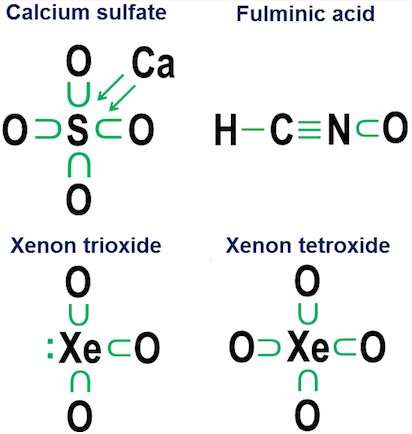
L'esafluoruro di zolfo, $ \ ce {SF6} $, fornisce un delizioso esempio di questa ambiguità. Come ho descritto schematicamente nella mia risposta originale, l'atomo di zolfo centrale in $ \ ce {SF6} $ può essere interpretato come:
(a) Un atomo di zolfo in cui tutti e 6 i suoi elettroni di valenza sono stati completamente ionizzato via da sei atomi di fluoro, o
(b) un atomo di zolfo con un guscio di valenza di 12 elettroni stabile e altamente simmetrico che è sia creato che stabilizzato da sei atomi di fluoro situati in posizione ottaedrica, ciascuno dei quali covalentemente condivide una coppia di elettroni con l'atomo di zolfo centrale.
Sebbene entrambe queste interpretazioni siano plausibili da una prospettiva puramente strutturale, l'interpretazione della ionizzazione presenta seri problemi.
Il primo e il più grande problema è che ionizzare completamente tutti e 6 gli elettroni di valenza dello zolfo richiederebbe livelli di energia non realistici ("astronomico" potrebbe essere una parola più appropriata).
Un secondo problema è che la stabilità e la simmetria ottaedrica pulita di $ \ ce {SF6} $ suggerisce fortemente che i 12 elettroni attorno all'atomo di zolfo hanno raggiunto una stabilità, ben definita ed energia minima che è diversa dalla sua consueta struttura ad ottetto.
Entrambi i punti implicano che l'interpretazione più semplice ed energeticamente accurata del guscio di valenza di zolfo in $ \ ce {SF6} $ è che ha 12 elettroni in una configurazione stabile, non ottetto.
Nota anche che per lo zolfo questo minimo di energia stabile di 12 elettroni non è correlato al maggior numero di elettroni correlati alla valenza visti nei gusci degli elementi di transizione, poiché lo zolfo semplicemente non ha abbastanza elettroni per accedere a quegli orbitali più complessi. Il guscio di valenza a 12 elettroni di $ \ ce {SF6} $ è invece una vera flessione delle regole per un atomo che in quasi tutte le altre circostanze preferisce avere un ottetto di elettroni di valenza.
Ecco perché il mio la risposta generale a questa domanda è semplicemente "sì".
Domanda: Perché gli ottetti sono speciali?
Il rovescio della medaglia se le shell di valenza non ottetti stabili esiste è questo: perché i gusci di ottetti forniscono un minimo di energia così profondo e universale che l'intera tavola periodica è strutturata in righe che terminano (ad eccezione dell'elio) con gas nobili con gusci di valenza di ottetto?
In in poche parole, il motivo è che per ogni livello di energia superiore al caso speciale del $ n = 1 $ shell (elio), l'insieme orbitale "closed shell" $ \ {s, p_x, p_y, p_z \} $ è l'unico combinazione di orbitali i cui momenti angolari sono (a) tutti mutuamente ortogonali e (b) coprono tutte queste possibilità ortogonali per lo spazio tridimensionale.
È questa partizione ortogonale unica delle opzioni di momento angolare in 3D spazio che rende l'ottetto orbitale $ \ {s, p_x, p_y, p_z \} $ particolarmente profondo e rilevante anche nei gusci a più alta energia. Ne vediamo la prova fisica nella sorprendente stabilità dei gas nobili.
La ragione per cui l'ortogonalità degli stati del momento angolare è così importante su scala atomica è il principio di esclusione di Pauli, che richiede che ogni elettrone abbia il proprio stato unico. Avere stati di momento angolare ortogonale fornisce un modo particolarmente semplice e pulito per fornire una forte separazione di stato tra gli orbitali degli elettroni, e quindi per evitare le maggiori penalità energetiche imposte dall'esclusione di Pauli.
L'esclusione di Pauli, al contrario, rende insiemi di orbitali incompletamente ortogonali sostanzialmente meno attraente energeticamente. Poiché costringono più orbitali a condividere lo stesso spazio sferico degli orbitali $ p_x $, $ p_y $ e $ p_d $ completamente ortogonali dell'ottetto, gli orbitali $ d $, $ f $ e superiori sono sempre meno ortogonali e quindi soggetto a crescenti penalità energetiche di esclusione Pauli.
Una nota finale
Potrei aggiungere in seguito un altro addendum per spiegare l'ortogonalità del momento angolare in termini di classica, satellite -tipo orbite circolari. Se lo faccio, aggiungerò anche un po 'di spiegazione sul motivo per cui gli orbitali $ p $ hanno forme dumbell così stranamente diverse.
(Un suggerimento: se hai mai visto persone creare due loop in una singola corda per saltare, le equazioni dietro questi doppi anelli hanno somiglianze inaspettate con le equazioni dietro gli orbitali $ p $.)
Risposta originale del 2014 (invariata)
Questa risposta intende integrare la risposta precedente di Manishearth, piuttosto che competere con essa. Il mio obiettivo è mostrare come le regole dell'ottetto possono essere utili anche per le molecole che contengono più del solito complemento di otto elettroni nel loro guscio di valenza.
La chiamo notazione della donazione e risale al mio liceo giorni in cui nessuna parte della chimica dei testi nella biblioteca della mia piccola città si preoccupava di spiegare come funzionassero quei legami di ossigeno in anioni come carbonato, clorato, solfato, nitrato e fosfato.
L'idea alla base di questa notazione è semplice. Inizi con la notazione del punto dell'elettrone, quindi aggiungi le frecce che mostrano se e come gli altri atomi stanno "prendendo in prestito" ogni elettrone. Un punto con una freccia significa che l'elettrone "appartiene" principalmente all'atomo alla base della freccia, ma viene utilizzato da un altro atomo per completare l'ottetto di quell'atomo. Una semplice freccia senza alcun punto indica che l'elettrone ha effettivamente lasciato l'atomo originale. In tal caso, l'elettrone non è più attaccato alla freccia ma viene invece mostrato come un aumento del numero di elettroni di valenza negli atomi all'estremità della freccia.
Ecco alcuni esempi che utilizzano la tabella sale (ionico) e ossigeno (covalente):

Notare che il legame ionico di $ \ ce {NaCl} $ si presenta semplicemente come una freccia, indicando che ha "donato" il suo elettrone più esterno ed è ricaduto nel suo ottetto interno di elettroni per soddisfare le proprie priorità di completamento. (Tali ottetti interni non vengono mai mostrati.)
I legami covalenti si verificano quando ogni atomo contribuisce con un elettrone a un legame. La notazione di donazione mostra entrambi gli elettroni, quindi l'ossigeno a doppio legame finisce con quattro frecce tra gli atomi.
Tuttavia, la notazione di donazione non è realmente necessaria per semplici legami covalenti. È inteso più per mostrare come funziona il legame negli anioni. Due esempi strettamente correlati sono il solfato di calcio ($ \ ce {CaSO4} $, meglio noto come gesso) e il solfito di calcio ($ \ ce {CaSO3} $, un comune conservante alimentare):
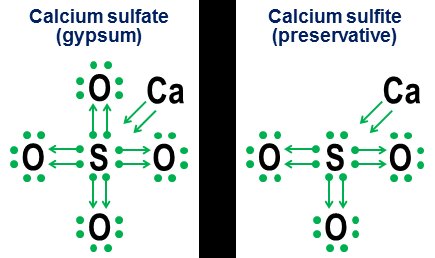
In questi esempi il calcio dona tramite un legame prevalentemente ionico, quindi il suo contributo diventa una coppia di frecce che donano due elettroni al nucleo dell'anione, completando l'ottetto dell'atomo di zolfo. Gli atomi di ossigeno si attaccano quindi allo zolfo e "prendono in prestito" intere coppie di elettroni, senza contribuire realmente in cambio. Questo modello di prestito è un fattore importante nel motivo per cui può esserci più di un anione per elementi come lo zolfo (solfati e solfiti) e l'azoto (nitrati e nitriti). Poiché gli atomi di ossigeno non sono necessari affinché l'atomo centrale stabilisca un ottetto completo, è possibile che alcune delle coppie nell'ottetto centrale rimangano separate. Ciò si traduce in anioni meno ossidati come solfiti e nitriti.
Infine, un esempio più ambiguo è l'esafluoruro di zolfo:
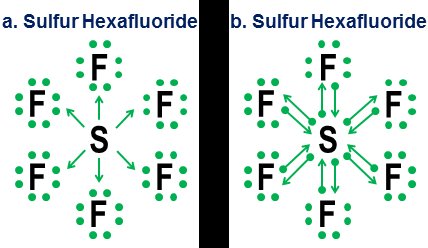
La figura mostra due opzioni. $ \ Ce {SF6} $ dovrebbe essere modellato come se lo zolfo fosse un metallo che cede tutti i suoi elettroni agli atomi di fluoro iper-aggressivi (opzione a), o come un caso in cui la regola dell'ottetto lascia il posto a una più debole ma regola dei 12 elettroni ancora praticabile (opzione b)? Ci sono alcune controversie anche oggi su come gestire questi casi. La notazione della donazione mostra come una prospettiva ottetto possa ancora essere applicata a questi casi, sebbene non sia mai una buona idea fare affidamento su modelli di approssimazione del primo ordine per casi così estremi.
2014-04- 04 Update
Infine, se sei stanco di punti e frecce e desideri qualcosa di più vicino alla notazione dei legami di valenza standard, queste due equivalenze tornano utili:
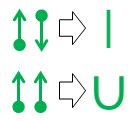
L'equivalenza della linea retta superiore è banale poiché la linea risultante è identica nell'aspetto e nel significato al legame covalente standard della chimica organica.
Il secondo legame a u la notazione è quella del romanzo. L'ho inventato per frustrazione al liceo negli anni '70 (sì, sono così vecchio), ma all'epoca non ci ho mai fatto niente.
Il vantaggio principale della notazione u-bond è che consente di prototipare e valutare relazioni di legame non standard utilizzando solo valenze atomiche standard. Come per il legame covalente in linea retta, la linea che forma il legame a U rappresenta una singola coppia di elettroni. Tuttavia, in un legame a U, è l'atomo nella parte inferiore dell'U che dona entrambi gli elettroni nella coppia. Quell'atomo non ottiene nulla dall'accordo, quindi nessuna delle sue esigenze di legame viene modificata o soddisfatta. Questa mancanza di completamento del legame è rappresentata dall'assenza di qualsiasi linea che termina su quel lato del legame a U.
L'atomo del mendicante in cima alla U può usare entrambi degli elettroni gratuitamente, il che a sua volta significa che due dei suoi bisogni di legame di valenza sono soddisfatti. Notazionalmente, questo è riflesso dal fatto che entrambe le estremità della linea della U sono accanto a quell'atomo.
Considerato nel suo insieme, l'atomo alla base di un legame a U sta dicendo "Io non Mi piace, ma se così hai un disperato bisogno di un paio di elettroni e se prometti di starci molto vicino, ti lascerò attaccare a un paio di elettroni dal mio già completato ottetto. "
Il monossido di carbonio con il suo sconcertante" perché il carbonio ha improvvisamente una valenza di due? " mostra bene come i legami a U interpretano tali composti in termini di numeri di legame più tradizionali:

Si noti che due dei quattro legami del carbonio sono risolti da legami covalenti standard con l'ossigeno, mentre i restanti due legami di carbonio vengono risolti dalla formazione di un legame a u che consente al carbonio mendicante di "condividere" una delle coppie di elettroni dall'ottetto già pieno di ossigeno. Il carbonio finisce con quattro estremità di linea, che rappresentano i suoi quattro legami, e l'ossigeno finisce con due. Entrambi gli atomi hanno quindi i loro numeri di legame standard soddisfatti.
Un'altra intuizione più sottile da questa figura è che poiché un legame u rappresenta una singola coppia di elettroni, la combinazione di un legame u e due legami covalenti tradizionali tra gli atomi di carbonio e ossigeno coinvolge un totale di sei elettroni, e quindi dovrebbe avere somiglianze con il triplo legame a sei elettroni tra due atomi di azoto. Questa piccola previsione si rivela corretta: le molecole di azoto e monossido di carbonio sono infatti omologhe della configurazione elettronica, una delle conseguenze è che hanno proprietà chimiche fisiche quasi identiche.
Di seguito sono riportati alcuni altri esempi di come la notazione u-bond possa far sembrare un po 'meno misteriosi anioni, composti di gas nobili e strani composti organici: