Perché il fluoro non può essere l'atomo centrale nei composti inter-alogeni?
Prima di tutto, il fluoro può essere al "centro delle cose". Gli esempi includono l'acido fluoridrico fortemente legato all'idrogeno

e l ' esempio molto rilevante del trifluoruro anione
$$ \ ce {[FFF] ^ -} $$
L'esempio dell'anione trifluoruro è critico in quanto dimostra che il fluoro può essere ipercoordinato (ipervalente). Ovviamente, in questo ultimo esempio abbiamo "indotto" il fluoro a occupare la posizione centrale, quindi la tua domanda rimane (leggermente alterata), perché il fluoro non occupa una posizione centrale più spesso?
In per rispondere a questa domanda, è necessario considerare due casi generali,
- La situazione anionica $ \ ce {[XFX] ^ -} $ vs. $ \ ce {[XXF] ^ -} $
- La situazione cationica $ \ ce {[XFX] ^ +} $ vs. $ \ ce {[XXF] ^ +} $
dove X è Cl, Br o I.
Nel caso dell'anione, le strutture a punti di Lewis suggeriscono una carica negativa sull'atomo centrale.
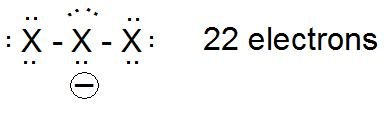
Tuttavia, l'analisi computazionale della distribuzione degli elettroni nell ' anione triioduro (vedere p. 156) suggerisce che l'atomo centrale sia caricato positivamente (+0,27 elettroni), mentre gli atomi terminali sono caricati negativamente (-0,63 elettroni su ciascun atomo terminale). Supponendo che la stessa tendenza generale sarebbe applicabile agli anioni trialogenuri misti, quindi nel caso di $ \ ce {[XFX] ^ -} $ si collocherebbe una carica positiva sull'atomo di fluoro altamente elettronegativo invece del più grande, più polarizzabile (es. più capace di sostenere una carica positiva) atomo di bromo, cloro o iodio.
Nel caso del catione, entrano in gioco argomenti simili. Di nuovo, calcoli per una varietà di cationi trialogenuri (misti e omogenei) suggeriscono una sostanziale carica positiva sull'atomo centrale (questa volta in accordo con le strutture di Lewis Dot). Gli stessi argomenti fatti sopra funzionerebbero qui per destabilizzare le strutture con un atomo di fluoro centrale. Questa analisi ha anche rilevato legami estremamente lunghi (meno stabilizzanti) risultanti quando il fluoro (o il più elettronegativo dei 3 atomi) occupava la posizione centrale.
Argomenti che non spiegano il la presenza rara di fluoro in una posizione centrale nei composti inter-alogeni include:
- la mancanza di "d-orbitali" ; come altri hanno commentato, questo è un vecchio argomento non valido; l'esistenza di $ \ ce {F3 ^ -} $ dimostra che il fluoro è capace di legami ipercoordinati senza la necessità di coinvolgimento d-orbitale
- sovrapposizione inefficiente 2p-3p ; $ \ ce {FCl} $ ha una forza di adesione maggiore e un calore di formazione inferiore rispetto a $ \ ce {Cl2} $