Ok. Dimentica per un secondo tutto ciò che riguarda gli orbitali.
Hai dei nuclei. Hai elettroni intorno a loro.
Primo passo: gli elettroni non sono sfere. Immaginali come una carica imbrattata nello spazio. Che è precisamente quello che sono: carica imbrattata nello spazio, con bordi sfocati, come un blob sfocato. La forma di questo blob dipende da molti fattori, ma il più grande è la posizione dei nuclei.
Ora supponi di voler descrivere la forma di questo blob, come se volessi stamparlo in 3D. Un modo semplice sarebbe dividere lo spazio in cubetti e dire "carica" se hai qualche sbavatura o "nessun addebito" se non hai quella macchia. In pratica, poiché è sfocato, direste "carica 3.0" in alcuni cubi, "carica 1.3" in altri cubi, "carica 0.1" in altri cubi e così via. Questo è un modo perfettamente legittimo per descrivere quella che viene chiamata "densità di carica" nello spazio.
Il problema con questo approccio è che è piuttosto scomodo. Ha una scarsa precisione e scala male. Se riduci i cubetti, perché non ti piace vivere in un mondo di Minecraft, hai bisogno di molti più cubi per farlo.
Quindi ora c'è un metodo più intelligente per farlo e per spiegare ho bisogno che tu capisca la decomposizione di Fourier. Non è così difficile come pensi che suoni.
Il problema è il seguente. Hai un'onda sonora complessa, come quella prodotta soffiando un fischio o cantando una canzone, e risulta che puoi creare qualsiasi forma complessa di questa onda sommando insieme onde più semplici: un'attenta scelta di seno e coseno di determinate frequenze (toni) e con determinate intensità (volumi). Suonali tutti insieme, ottieni indietro l'onda iniziale.
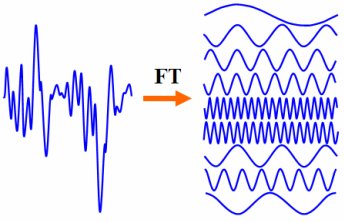
Questo è esattamente quello che vedi nel display dello spettro nel tuo stereo
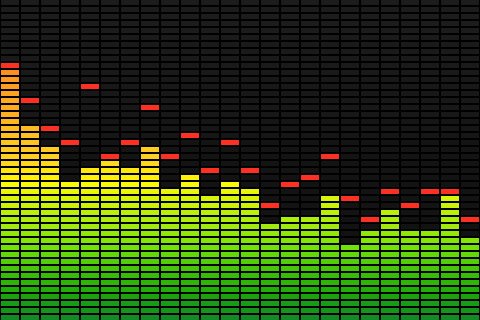
Dove ogni colonna è una frequenza diversa e l'altezza della colonna è l'intensità di quella particolare frequenza. Cambia continuamente perché stai suonando musica complessa, ma prova a suonare un suono uniforme (ad esempio un violino che suona una singola nota) e vedrai che rimane lo stesso per tutto il tempo.
Ora torna agli orbitali .
Gli orbitali sono i "seno e coseno" del nostro problema di descrivere quel blob. Abbiamo un'entità complessa (il nostro blob spalmato) e vogliamo descriverla sommando "qualcosa". Non importa quale "qualcosa" usiamo, ma risulta che le funzioni tridimensionali di quella forma hanno molte proprietà interessanti che rendono il problema molto più compatto.
Facciamo un semplice esempio. Supponi di avere una carica sferica. Questo è probabilmente descritto bene da un singolo orbitale di forma sferica (un orbitale s), esattamente come un'onda sinusoidale di un diapason è ben descritta da una singola funzione seno.
Ora aggiungi un campo elettrico in modo che il gli elettroni vengono tirati e la sfera imbrattata è ora più simile a un uovo allungato. Quella non è davvero descritta bene da una sfera, vero? quindi devi descrivere il lobo, il che significa che hai bisogno di un orbitale aggiuntivo (ap orbitale) da aggiungere al mix in modo che il risultato sia a forma di uovo, esattamente come se avessi bisogno di più di un'onda sinusoidale per descrivere il suono di un violino.
Questo è tutto, davvero. gli orbitali sono solo convenienti equivalenti 3d del seno e del coseno. Potremmo anche usare qualsiasi altra cosa (e in effetti lo facciamo, in alcuni casi) e funzionerebbe anche, ma con alcuni potenziali svantaggi.