Il modo normale per disegnare un profilo di reazione è posizionare una barriera tra reagenti e prodotti, proprio come mostrato nella domanda. Poiché la parte superiore della barriera è lo stato di transizione . Il percorso di reazione di solito non è ben definito come tale poiché ci sono molti angoli di legame e distanze che cambiano durante una reazione, tuttavia questa idea di un percorso è molto utile per capire cosa sta accadendo. Quello che mostra l'immagine, e anche la bella animazione, è che i reagenti si avvicinano, c'è una sorta di interazione e quindi i prodotti si formano. Tuttavia, l'immagine (o l'animazione) non ci dice come ciò avvenga e quali sono i fattori importanti è lasciato all'immaginazione.
In primo luogo, i reagenti devono acquisire energia sufficiente per raggiungere lo stato di transizione nella parte superiore della barriera. L'energia media dei reagenti è solitamente rappresentata come la linea a sinistra della figura con la parola reagenti. Questa energia è solitamente molto inferiore all'altezza della barriera (eccetto per le reazioni controllate dalla diffusione, vedi sotto), e questo significa che la maggior parte delle volte in cui i reagenti entrano in collisione tra loro non si verifica alcuna reazione. Non c'è abbastanza energia per reagire, indipendentemente dal fatto che la reazione sia endotermica o esotermica.
Ora, poiché la molecola è in soluzione o in fase gassosa a una pressione ragionevole di gas tampone inerte, si verificheranno molte collisioni al secondo tra reagenti e solvente (o gas tampone. In soluzione si verificano collisioni a un tasso di almeno $ 10 ^ {12} s ^ {- 1} $. Solo occasionalmente, forse 1 su $ 10 ^ 9 $ collisioni uno sarà abbastanza energico da dare ai reagenti energia sufficiente per raggiungere la cima della barriera. stato di transizione la reazione può verificarsi, a condizione che i reagenti siano nell'orientamento corretto e che una collisione si verifichi abbastanza rapidamente mentre si è lì per rimuovere abbastanza energia dallo stato di transizione e quindi abbassare l'energia rendendo impossibile reagire.
Sebbene l'energia cinetica media del solvente sia $ 3RT / 2 $ per mole, ed è piccola < 4kJ / mol, esiste una distribuzione di energie data dalla distribuzione di Boltzmann. La possibilità di avere un'energia $ E $ è proporzionale a $ exp (-E / (RT)) $ quindi è molto piccola se $ E $ è, diciamo, 100kJ / mol ed è per questo che molte reazioni hanno piccole costanti di velocità e perché sono necessarie così tante collisioni prima che possa verificarsi una reazione.
Una volta nello stato di transizione, poiché l'energia è qui ben al di sopra della media, in media una collisione con il solvente rimuoverà un po 'di energia, invece di aggiungerla, e così il prodotto si stabilizzerà.
(La descrizione fornita qui è piuttosto rozza, considerazioni più dettagliate portano alla modifica di Kramers alla teoria dello stato di transizione, e questo implica la considerazione dell '' attrito 'sulla coordinata di reazione, sia dal solvente che dalle vibrazioni interne in i reagenti ostacolano o supportano il movimento lungo la coordinata di reazione.
In alcune reazioni la barriera alla reazione è molto piccola, il che significa che è solo leggermente maggiore dell'energia media a quella temperatura. In questo caso, una volta che i reagenti entrano in collisione tra loro, si verifica una reazione. La velocità di reazione è ora limitata dalla rapidità con cui i reagenti possono collidere e ciò è determinato dalle loro costanti di diffusione, che a loro volta dipende dalla viscosità della soluzione. Queste sono reazioni "controllate dalla diffusione". Nello stesso solvente hanno sempre una costante di velocità maggiore rispetto a una reazione con una barriera più grande.
È importante rendersi conto che la prova sperimentale di cosa siano gli stati di transizione è davvero molto, molto approssimativa. Nella bella animazione possiamo vedere i legami allungarsi e rompersi ecc., Ma questo è forse basato su calcoli, certamente sull'intuizione chimica, e su prove circostanziali da esperimenti chimici ma che non sono quelli spettroscopici risolti nel tempo. Il motivo per non essere in grado di individuare uno stato di transizione è che dura solo circa $ 10 ^ {- 13} $ al massimo, e probabilmente meno, e anche nelle reazioni iniziate con un impulso laser a femtosecondi non è stato possibile rilevarle anche in reazioni fotoindotte come la fotoisomerizzazione trans-cis dello stilbene (difeniletene) presumibilmente perché la loro concentrazione è minima.
In reazioni semplici come O + H $ _2 $ = H + OH, che vengono eseguite in un fascio molecolare, sono stati possibili molti più progressi. Queste reazioni vengono misurate a una pressione del gas molto bassa e un fascio di atomi interseca un fascio di molecole ei prodotti vengono analizzati spettroscopicamente e / o per la loro distribuzione energetica e spaziale.
È possibile tracciare una superficie energetica potenziale come una serie di contorni, proprio come una mappa che mostra colline e valli. Sebbene la superficie sia empirica, viene calcolata utilizzando potenziali vibrazionali noti per le molecole biatomiche e l'approccio del legame di Valence di Heitler-London. (La superficie si chiama LEPS dopo London, Eyring, Polanyi e Sato.)
La Figura 1 mostra l'energia potenziale tracciata rispetto alla separazione OH + H (presa dal centro di OH) come ordinata e la separazione O + H $ _2 $ come ascissa. (Si noti che il calcolo presupponeva che la collisione fosse lineare (solo fine) tra O + H $ _2 $ e che le rotazioni H $ _2 $ non sono incluse nell'impostazione dei parametri di collisione iniziali) Lo stato di transizione è nel punto circa (0,12, 0,09 ), cerchio giallo. Questo è nel "punto di sella", dove la superficie ha una curvatura convessa lungo il percorso di reazione e una curvatura concava perpendicolare a questo. Il colore blu scuro mostra l'energia più bassa, l'intermedio giallo / verde e il rosso più alto.
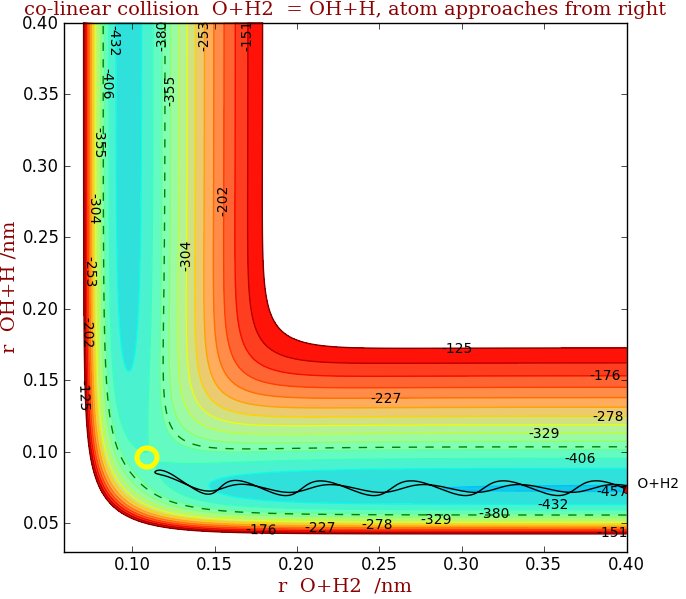
La linea continua mostra una traiettoria di una co- collisione lineare tra O + H $ _2 $ e inizia all'estrema destra della figura. I contorni della linea tratteggiata descrivono l'energia totale, l'energia collisionale (cinetica) più l'energia vibrazionale iniziale in H $ _2 $. Le oscillazioni nella valle di destra mostrano la vibrazione di H $ _2 $ quando si avvicina all'atomo di O. Nella fig 1 sebbene ci sia abbastanza energia totale, le vibrazioni sono tali che la molecola si trova nel punto sbagliato del potenziale, a causa della sua velocità iniziale e dell'energia vibratoria, per attraversare lo stato di transizione e così tornare a valle. Non si è verificata alcuna reazione.
Nella seconda figura, lo stato di transizione è attraversato, sebbene l'energia totale sia la stessa, poiché le vibrazioni posizionano i reagenti nel punto giusto sulla superficie. Le vibrazioni nel prodotto OH possono essere viste nella valle verticale. Quindi il punto importante è che non è solo l'energia totale, ma anche l'orientamento e l'energia vibrazionale che sono importanti per provocare la reazione.
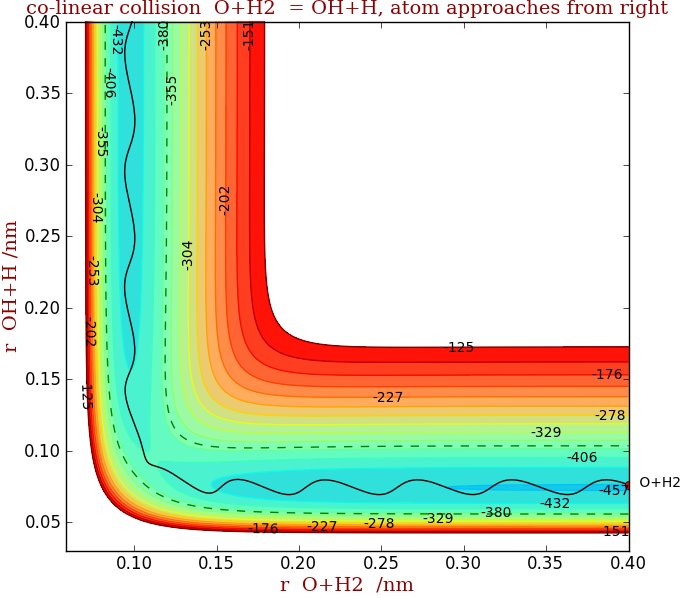
Osservando le energie rotazionali e vibrazionali nei prodotti e nei reagenti in reazioni come queste, è possibile stabilire la superficie energetica potenziale. La connessione con le costanti di velocità (termiche) misurate in esperimenti di cinetica chimica normale (fascio non molecolare) viene effettuata calcolando il numero di attraversamenti dello stato di transizione a una data energia e quindi calcolando la media sulle energie collisionali e cinetiche.