Sosterrò che la distanza tra le molecole generalmente aumenta con la temperatura per ragioni fondamentali, sebbene il ghiaccio normale (I h ) e l'acqua liquida siano un'eccezione. A basse temperature, le sostanze riducono al minimo la loro energia, il che di solito si traduce in disposizioni cristalline ordinate. A temperature elevate, le sostanze massimizzano la loro entropia. Cioè, ad alte temperature tutto è il più casuale e mescolato possibile.
Supponendo che tu abbia uno spazio vuoto, ci sono più modi per mettere due molecole distanti che per mettere due moleucole vicine . Puoi vederlo nel diagramma sottostante. Ci sono più modi per posizionare una seconda molecola nel guscio sferico blu, a grande distanza dalla molecola d'acqua centrale, che per posizionare le molecole d'acqua nel guscio sferico arancione, a breve distanza dalla molecola d'acqua centrale. Infatti, il numero di modi per posizionare la seconda molecola d'acqua aumenta con il volume del guscio sferico, che è come 4πR 2 , dove R è la distanza tra le molecole. Quindi, lo stato in cui due molecole d'acqua hanno una grande distanza tra loro ha un'entropia maggiore dello stato in cui hanno una breve distanza tra loro.
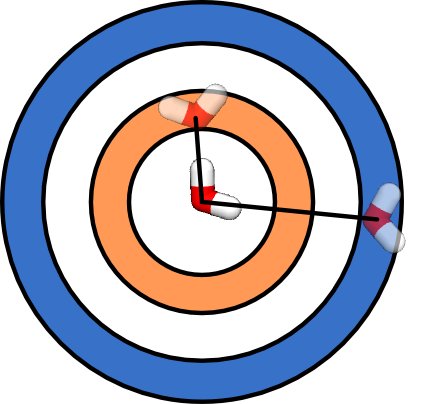
Semplicemente a causa della geometria, alle alte temperature, le molecole tenderanno ad essere molto distanti. L'acqua bolle ad alta temperatura semplicemente perché ci sono più modi per disperdere le molecole d'acqua in tutta la cucina che per mettere tutte le molecole d'acqua nella pentola. La maggior parte delle sostanze diventa gas a temperature sufficientemente elevate, dato uno spazio vuoto sufficiente. La maggior parte delle sostanze si espande all'aumentare della temperatura.
L'aggiunta di distanza tra le molecole non è l'unico modo per aumentare l'entropia, il che spiega l'eccezione dello scioglimento del ghiaccio. L'entropia può anche aumentare rendendo la disposizione delle molecole e il loro orientamento più disordinati. L'acqua liquida ha più entropia del ghiaccio non perché le molecole siano più distanti, ma perché sono disposte e orientate in modo più casuale.