Preambolo
Per quanto banale possa sembrare questa domanda, non lo è. Non dovrebbe certamente essere mai posta a un livello di esame inferiore alla chimica quantistica di base.
Tutti gli allettanti schemi di spiegazione falliranno sicuramente. Un'immagine di legame nel formalismo di Lewis è quasi impossibile; Le descrizioni dell'ibridazione in questi composti sono estremamente complesse.
Come suggerimento generale: Più piccola è la molecola, più complicato è il legame.
Cos'è la stabilità?
Questa domanda sembra così semplice, ma è incredibilmente complessa. Come chimico quantistico, vedo qualsiasi molecola stabile se è un pozzo energetico (punto stazionario) sulla superficie energetica potenziale (e questa potrebbe già essere una semplificazione). Questo concetto non aiuta in alcun modo quando si vogliono confrontare le stabilità, perché è solo una proprietà di una particolare disposizione di nuclei in un particolare stato.
Non esiste una cosa come la stabilità assoluta. Non possiamo misurarlo. È un concetto astratto, che ci piace pensare di capirlo. Un esempio dal mondo reale: il ghiaccio è stabile sotto 0 ° C e il vapore è stabile sopra 100 ° C. Tuttavia il ghiaccio non è più stabile del vapore.
Confrontando la stabilità, abbiamo sempre bisogno di un quadro di più variabili o costanti e di un punto di riferimento, pertanto si presume spesso che le condizioni al contorno siano le stesse (esattamente) . Anche a un livello puramente teorico è estremamente difficile trovare queste esatte condizioni al contorno. Prima o poi devi introdurre approssimazioni, che alla fine mandano in crash il tuo sistema, soprattutto per quanto riguarda il punto di riferimento.
È difficile, ma non impossibile.
Per confrontare la stabilità relativa di questi due cationi possiamo ipotizzare un ipotetico trasferimento di idruro tra loro, costruendo quindi un sistema di riferimento chiuso. Nella chimica computazionale usiamo il concetto di reazioni isodesmiche per tali scopi. Ovviamente non è privo di pregiudizi e di un'ipotesi completa, ma può darci qualche intuizione in più.
In questo caso possiamo proporre la seguente ipotetica reazione isodesmica:

Nota che il numero di legami dello stesso tipo sono gli stessi su ogni lato sono uguali. Almeno abbastanza vicino. Si potrebbe obiettare che rompiamo un legame idrogeno sp²-carbonio e formiamo un legame idrogeno sp-carbonio, e viceversa, quindi non avendo gli stessi tipi di legami sul lato sinistro e destro. Ma questo è probabilmente il più vicino possibile.
Dopo aver impostato un insieme conciso di parametri, possiamo ora andare avanti ed eseguire alcuni calcoli di chimica quantistica. Ho deciso di utilizzare il mio standard personale: DF-BP86 (D3BJ) / def2-SVP livello di teoria.
E incontriamo più problemi
Le molecole a guscio chiuso singoletto benzene ( nonostante aromaticità) e acetilene non sono un problema. Ma quando arriviamo ai cationi, le cose si fanno interessanti.
Neanche il catione fenilico propone una grande minaccia, è abbastanza grande da compensare l'orbitale vuoto nei sistemi σ e π.
L'elevata simmetria della molecola di acetilene rende impossibile trattare a questo livello di teoria. La forma lineare è - secondo la mia definizione - non stabile. Almeno non a questo livello di teoria, almeno non allo stato singoletto. Ciò di cui abbiamo bisogno è almeno un metodo multi-riferimento come CASSCF. E poi ancora non sappiamo quale stato è preferito e se possiamo ancora usare la nostra ipotetica reazione proposta. Perché se lo stato di rotazione è diverso su entrambi i lati, l'intera cosa va in pezzi.
Risultati
Tuttavia, mentre ci siamo già, esaminiamo alcuni dei risultati e chiarire alcune idee sbagliate.
Benzene e fenilcation
Durante la ionizzazione, il sistema deve compensare il cambiamento con un cambiamento nella geometria. Questo è un effetto puramente elettronico. Nel benzene tutti gli atomi di carbonio sono coordinati trigonali, avendo abbastanza bene tre orbitali ibridi sp²; è uno dei pochissimi esempi, dove la simmetria lo impone. Rimuovere uno ione idruro significa anche rimuovere elettroni da un tale orbitale, liberando un carattere s più stabile. Di conseguenza, l'angolo di legame si allarga per accogliere più carattere s nei legami carbonio-carbonio. Ora questo porta a una geometria visibilmente distorta - un delicato equilibrio di molteplici fattori.

Il sistema π rimane in gran parte indisturbato. I legami σ compensano quasi completamente il cambiamento. Il carbonio cationico è ora meglio descritto come essere tra lineare e trigonale, quindi avente orbite ibride tra sp e sp².
Acetilene e carbocatione etinile
L'acetilene è una molecola meravigliosa di per sé. Ha una simmetria estremamente alta, cosa piuttosto rara per quattro atomi. Con ciò arriva un gran numero di orbitali degeneri. E una situazione di legame molto complicata.
Potresti considerare gli atomi di carbonio come aventi orbitali ibridi sp, e questa va bene come approssimazione, ma più a fondo scavi, più inquietante diventa. (Vedi anche regola di Bent.)
Disturbare questa molecola in qualsiasi modo, provoca la rottura della simmetria. La versione lineare di HCC + ha ancora un'elevata simmetria e ora abbiamo un problema. Dopo la rimozione dello ione idruro, la densità elettronica rimanente cercherà di utilizzare il più possibile il carattere s. Di conseguenza si cerca di ridistribuire parte del carattere s nel sistema π. Questi orbitali ora non corrispondono più alla simmetria spaziale e la molecola non è stabile nella sua forma lineare nello stato di singoletto. Questa non è tutta la verità, però, ma diventa molto più complicato e questo sarà sicuramente troppo per questa risposta.
Una struttura stabile a questo livello di teoria nello stato di singoletto è un anello di quasi tre membri. Probabilmente è meglio pensarlo come un dicarbonato protonato. Tutti i legami sono allungati rispetto all'acetilene.
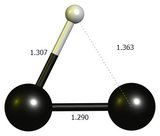
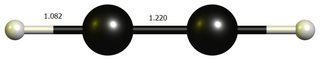
Poiché abbiamo una situazione di legame significativamente diversa ora, le ipotesi precedenti dello stesso tipo di legami sinistra e destra vengono meno e non possiamo più confrontare queste due molecole nel quadro di riferimento dato.
(Senza rispetto per la scienza attuale, potremmo ancora farlo. saprebbe che il lato sinistro dell'equazione è circa 600 kJ / mol più stabile di quello destro.)
Conclusione
Il catione fenile potrebbe essere stabile, è un minimo locale a DF-BP86 / def2-SVP, mentre il catione acetilene non esiste. Il catione HCC è meglio pensato come una molecola di dicarbonato protonato.
Se ti ho capito correttamente, allora la tua ipotesi, che la "tensione" sull'anello è maggiore dell'instabilità degli orbitali nell'acetilene catione, è davvero sbagliato.